2022-06-29
一、CAR-T细胞疗法
CAR-T细胞疗法是指嵌合抗原受体T细胞。CAR-T细胞免疫疗法是新型治疗肿瘤的精准靶向疗法,也是未来攻克癌症肿瘤疾病的关键性技术之一。作为肿瘤免疫治疗的一种特异性疗法,CAR-T是通过细胞基因工程,利用识别肿瘤相关抗原抗体的嵌合蛋白与患者体内提取到的T细胞进行修饰,经过纯化和大规模扩增之后的T细胞导入回患者体内后能特异性识别肿瘤细胞相关抗原靶点,激活人体免疫反应,杀灭肿瘤细胞。
利用基因工程改造T细胞进而影响人体免疫反应的理念早在20世纪就被提出,但在2012年随着CAR-T疗法在临床实验中成功治疗了急性白血病。而迅速成为全球研究热点,并于2017年首次获批上市。CARs根据胞内共刺激结构域的发展已经衍生至5代,目前大多数公司的上市产品都属于基于二代CAR-T技术进行探索开发。
近年来CAR-T全球研究数量逐步增加,但大概有80%的CAR-T疗法临床试验处于临床前和临床I期。CAR-T 细胞免疫疗法的出现改变了血液肿瘤传统以化疗和放疗为主的治疗方式,目前大部分该疗法主要应用于血液肿瘤,而究其在治疗血液恶性肿瘤中取得的显著疗效,和血液恶性肿瘤具有特异性靶点之间的密不可分。其中,最成功并且研究最多的是表达在大多数急性淋巴细胞白血病(ALL),慢性淋巴细胞白血病(CLL)和 B 细胞淋巴瘤中的 CD19 靶点,其他热点靶点还有 CD20、CD30、BCMA、CD174 等。
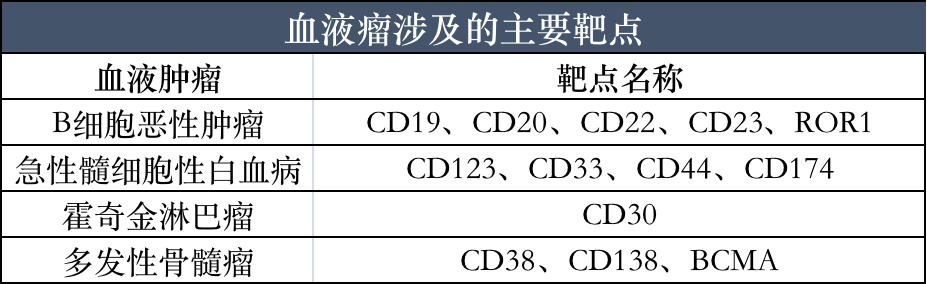
图1:血液瘤涉及的主要靶点
截止到今日,全球范围内共8款CAR-T产品上市。其中2款产品于国内上市。在欧美等国家已被广泛应用于临床。在美国,44% 的急性淋巴细胞白血病儿童患者接受 CAR-T 细胞治疗的临床应用,治愈率达到 60.6%;46% 的弥漫性大 B 细胞淋巴瘤成人患者接受CAR-T 细胞治疗,治愈率超过70%。
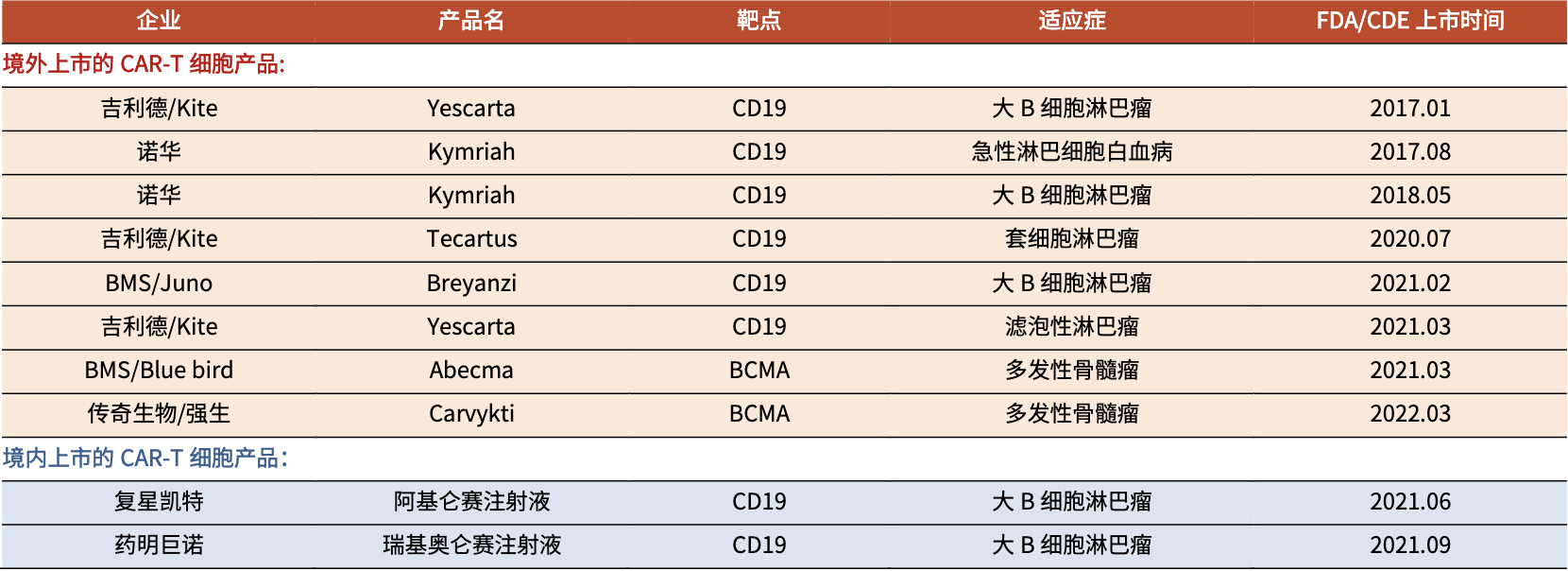
图2:已上市的CAR-T细胞治疗产品
二、CAR-T细胞疗法的治疗优势
血液肿瘤是起源于造血系统的一大类恶性肿瘤,主要包括多发性骨髓瘤、白血病和淋巴瘤,其中淋巴瘤可分为非霍奇淋巴瘤和霍奇淋巴瘤。血液瘤中以非霍奇淋巴瘤发病率最高,弥漫性大B细胞淋巴瘤是非霍奇淋巴瘤最常见的一种病症。IARC发布的数据显示,2020年世界血液瘤新发病例约128万,死亡病例数达到65万。同时血液肿瘤一线治疗后复发率较高,以弥漫性大B细胞淋巴瘤为例,30%-40%的患者会出现耐药或疾病复发情况。
在CAR-T细胞治疗出现之前,血液肿瘤的治疗方式多以放化疗为主,对比传统疗法,选择CAR-T疗法治疗血液肿瘤,无论是从治疗潜力还是治疗效果来说,都为更佳选择。
3、优异的治疗效果。CAR-T 细胞疗法已显示出比其他治疗方案更适合靶向特定疾病或按所需功能定制的潜力。CAR-T 细胞通过其 CAR 结构,能够特异性靶向多个肿瘤相关靶点,进而更精确地靶向不同肿瘤细胞。
三、CAR-T细胞疗法的局限性
目前CAR-T细胞疗法目前主要应用在末线血液恶性肿瘤治疗中,对于传统治疗手段已经失效的末线患者来说弥补了治疗空缺。与传统血液瘤治疗相比,CAR-T疗法因具有只需一次注射,一次用药,治疗周期短,对患者的创伤小,副作用小,治疗周期短,治疗精准度高等特点备受瞩目,但同时CAR-T细胞疗法也面临着诸多问题与挑战。
首先是市场化方面,一个“贵”字足以涵盖CAR-T细胞疗法目前的困局。首先这个“贵”是指价格,目前全球共有8款CAR-T细胞治疗产品上市,其中在国内上市的两款CAR-T产品阿基仑赛注射液和瑞基奥仑赛注射液,分别定价为120万元(人民币)和129万(人民币),相对于国外上市的产品,已经算得上是“良心价格”。但抛去其他可能会产生的影响来说,以这个价格来说,对于大部分家庭,已经是相当昂贵的费用,而且这仅为药品价格,CAR-T细胞治疗整体费用包括药品费用、治疗护理费用、重症监护室费用以及其他费用,其中治疗护理费用也包括预防/治疗在整个疗程中出现的副作用及配套治疗方案,比如常见副作用(细胞因子风暴CRS和毒副作用ICANS),非药品和药品的费用基本相当,这也导致CAR-T细胞治疗产品不太能走进“寻常百姓家”。
其次,凡事都要讲究一个“兵贵神速”,目前已上市CAR-T细胞疗法均源于自体,使用患者自身特定的 T 细胞需要时间,目前已上市产品进行制造生产周期在半个月到一个月之间。此外患者由于身体健康状况,可能无法提供足够的T细胞。因为病人在接受CAR-T治疗之前,大部分都会接受过化疗等细胞毒性治疗,导致T细胞数量下降,进一步增加了周期长度。长期的制备时间,也是CAR-T细胞治疗产品的局限之一。
除了以上两种局限,CAR-T细胞疗法作为新型疗法,影响其发展的因素还有很多,安全性、癌种局限性、相关政策的成熟度、规模化等痛点也是十分清晰。
2、癌种局限性。尽管 CAR-T 疗法在治疗血液恶性肿瘤上取得了可喜进展,但其在治疗实体瘤过程中仍面临诸多巨大挑战,CAR-T 细胞治疗实体瘤的疗效目前不如在血液肿瘤中效果显著。主要原因有两点:第一,实体瘤异质性高,缺乏适合CAR-T治疗的细胞表面靶点;第二,实体瘤具有强烈抑制免疫的微环境。
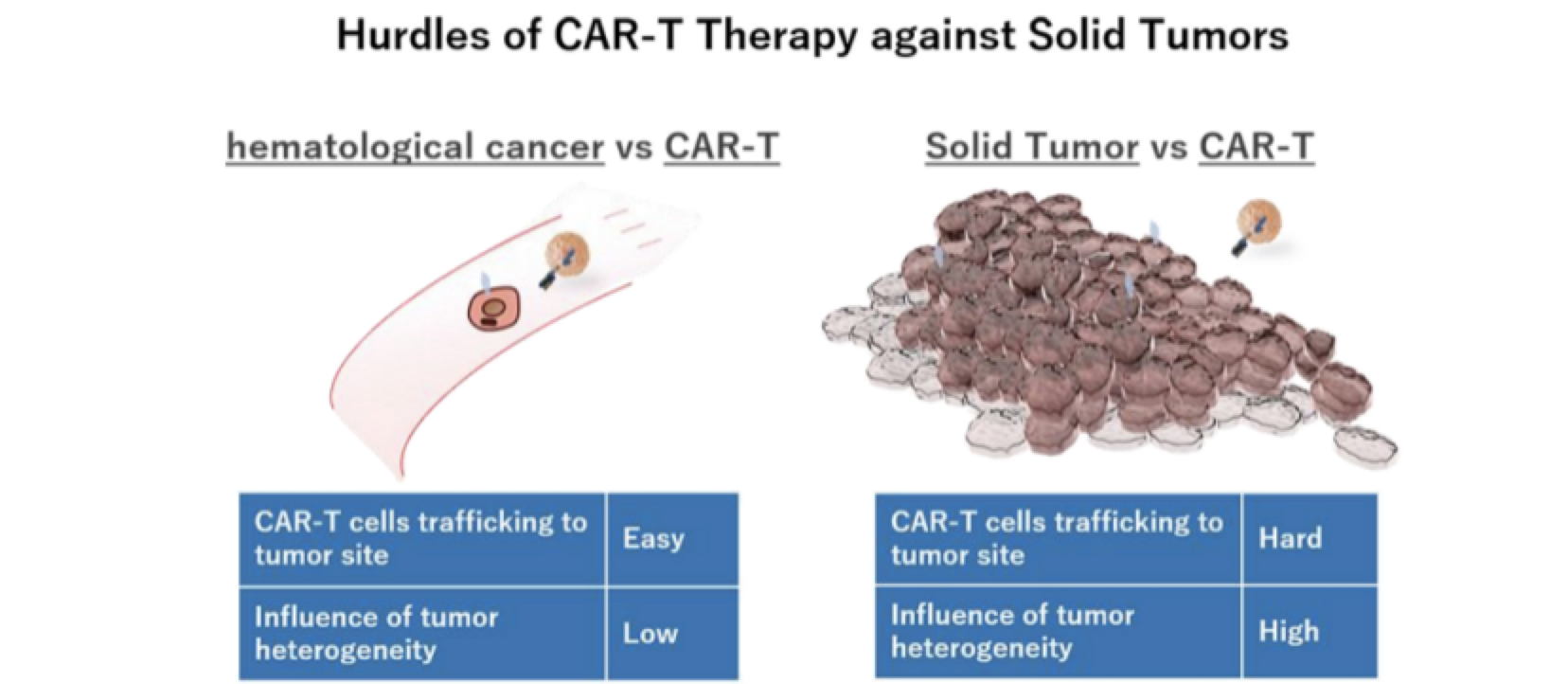
图3:CAR-T药物实体瘤治疗局限性
在监管方面,中国对于CAR-T疗法是属于药品还是医疗技术,监管权属于国家药监局还是国家卫健委研讨多年,2020年国家药品监督管理局CDE发布《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(征求意见稿)》,明确了将干细胞疗法按照药物管理,为CAR-T疗法的监管进一步明确方向。但相对来说,由于CAR-T细胞疗法属于新兴技术,在生产与监管方面依旧存在诸多问题,值得探讨与改进。
4、规模化。目前,不同公司的自体CAR-T细胞产品在生产制备中使用的方法各异,但基本的生产流程大体类似,主要包括T细胞筛选与富集、T细胞活化、T细胞基因转导、T细胞扩增以及T细胞冷冻保存等5大步骤。CAR-T细胞的生产流程环环相扣,任何一环的疏忽都会对最终产品的安全性、纯度以及效力产生深远影响。目前,CAR-T产品的每个生产环节都具有许多技术方法可供选择,难以建立标准化的工艺参数及条件,因此如何制定具有自动化、规模化且一致化的生产方案任重道远。
四、CAR-T细胞疗法如何破局
自CAR-T疗法上市以来,产品销售额持续增长,以2017年上市的两款产品为例,2017-2020年诺华公司的Kymriah全球销售额年复合增长率达329%,凯特公司的Yescarta全球销售额的年复合增长率达到331%。全球CAR-T细胞治疗市场从2017年的0.1亿美元增长到2021年的18亿美元。但对于CAR-T细胞治疗产品的投入来说,依旧是“入不敷出”。
作为潜力热门赛道,越来越多的企业加入了竞争。但如何直击痛点,成功破局,成为了大家讨论的热点。
首先依旧是咱们之前讨论过的“贵”,CAR-T细胞治疗产品的价格上的贵,主要受两方面影响:一是目前已上市的产品数量少,缺少竞争,其他治疗血液瘤的产品的效果不及CAR-T细胞治疗产品,在竞争少、效果好的强效光环加持下,会造成产品价格偏高,无法用于更多患者的治疗中;二是CAR-T细胞治疗产品属于新型疗法,从采集患者的免疫细胞、体外细胞培养、转染、扩增和回输等制备和治疗。由于试剂等耗材成本、CAR-T细胞的质控检测成本、细胞产品GMP厂房运营成本、第三方认证和质检的费用都很高,目前终端成本很难下降,而且CAR-T产品并没有进入医保,相关的商业保险项目也是少之又少,这也导致了其价格居高不下。
不过,目前国内有越来越多的企业进入到了CAR-T产品的研发之中,如复星凯特、药明巨诺、传奇生物、永泰生物、科济生物、上海细胞集团等,相关临床试验也呈井喷之势。
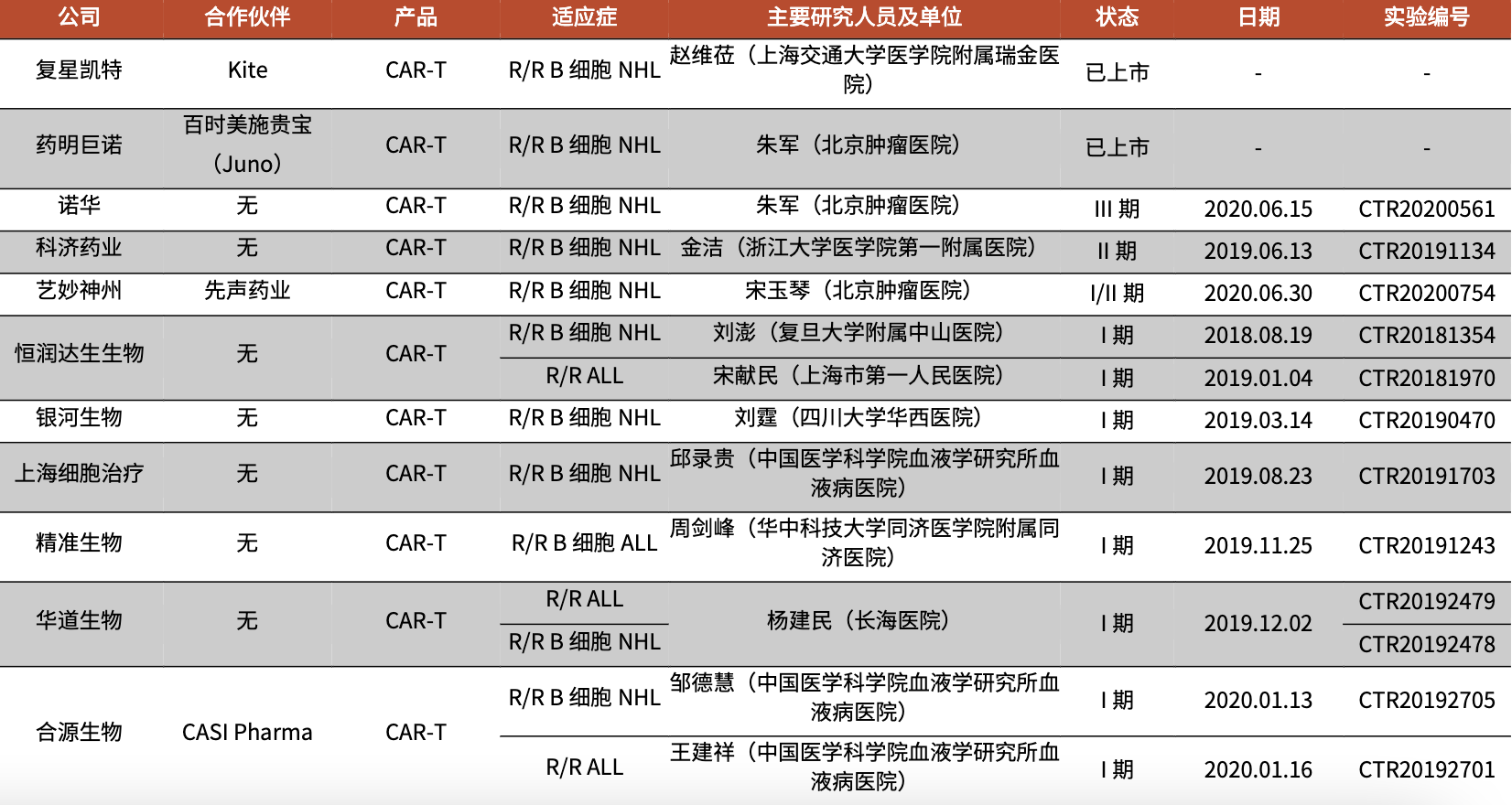
图4:国内靶向CD19的CAR-T产品管线
就像是PD-1一样,之前也有着“神药天价”之名,随着越来越多的产品成功上市,且有4款国产PD-1药物陆续进入医保目录,曾经的“天价药”逐渐为更多患者带来“福音”。而且在19年,美国国家医保机构Medicare于就确定了CAR-T产品的门诊报销方案,特定患者自费比例降低80%,成为CAR-T推广的重大利好。如果CAR-T也能有更多的产品进入市场,且能成功进入医保,将惠及到更多的肿瘤患者,这也将更好地推动CAR-T产品的市场发展。
而根据弗若斯特沙利文预测,2021年中国CAR-T市场规模约为2亿元,到2024年将增长至53亿元,至2030年市场规模有望达到289亿元,中国有望在未来短时间内弯道超车,占据大一部分全球市场份额。
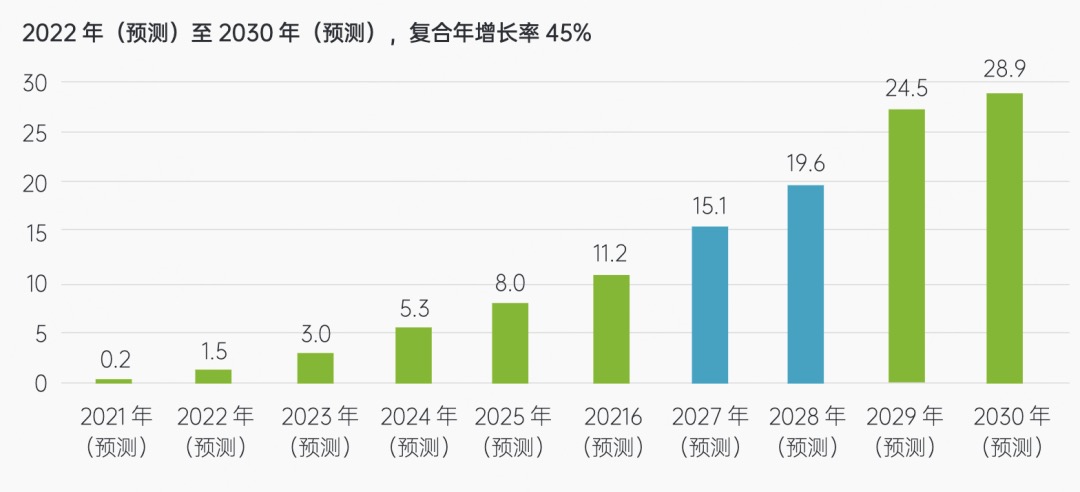
图5:CAR-T细胞疗法中国市场规模预测(十亿元)
除了价格上的“贵”,速度上的“贵”也未来可期。
从 2002 年起,许多科学家致力于修饰、改造 CAR-T 结构的胞内信号转导区,以进一步提高治疗效果。根据“共刺激分子序列”结构的不同,CAR-T 细胞分为五代,目前已上市产品均为第二代,特点是添加了共刺激结构域 CD28或 4-1BB。
而第三代含有两个共刺激结构域、三个胞内信号组分(CD3ζ、CD28、4-1BB或 OX40)。三代 CAR 结构使细胞具有更强的肿瘤抑制、裂解能力。第四代添加了自杀基因,可在具有免疫抑制性的肿瘤微环境中释放促炎性因子,从而招募并活化更多的免疫细胞、增强免疫反应。
当然最终目的还是第五代——通用型 CAR-T 细胞,突破个体限制,实现规模化生产和治疗。包括:通用 CAR 设计和通用 T 细胞设计。
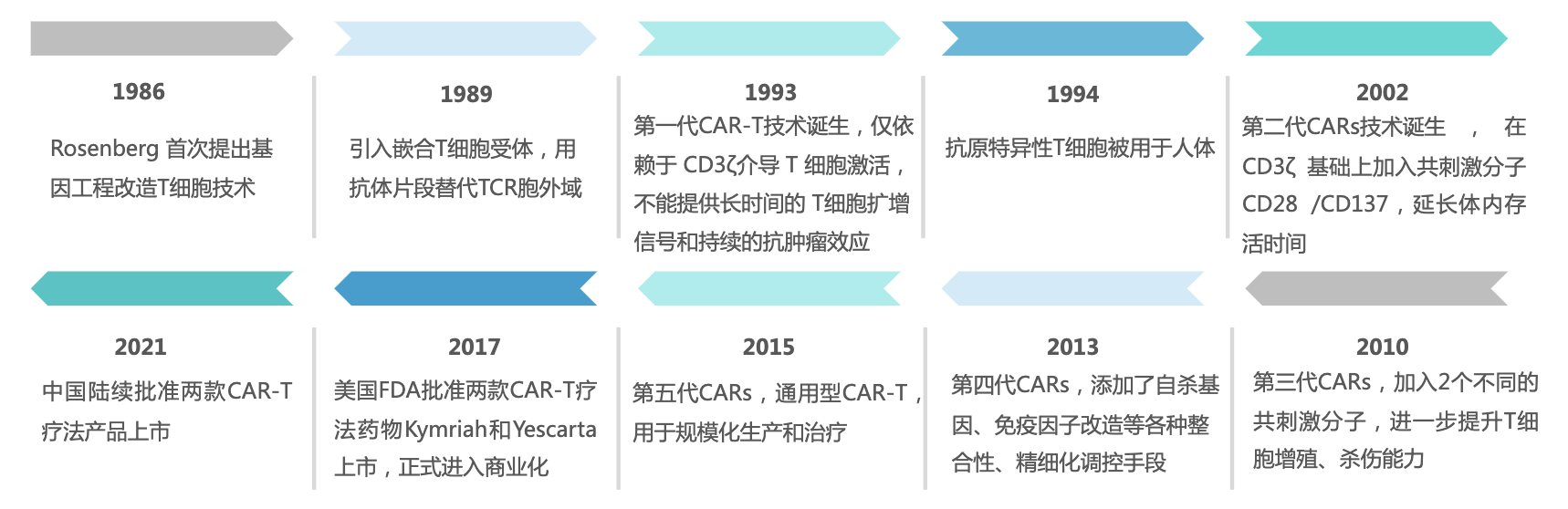
图6:CAR-T技术发展历程
目前处于研究中的解决方案是通过生产 “通用型”CAR-T 产品降低成本,异体的问题是会产生免疫排斥以及宿主移植病,解决方案是通过 CRISPR Cas9 等基因编辑工具敲除或者破坏 HLA 和 TCR 相关功能基因。生产周期方面,历经从病人取样、运输、生产及扩增、质量检测及放行,时间一般长达 3 周以上。从产品特性来看,通用型CAR-T疗法不受限于细胞来源,并且具备规模化效应,理论上能够解决大部分障碍。
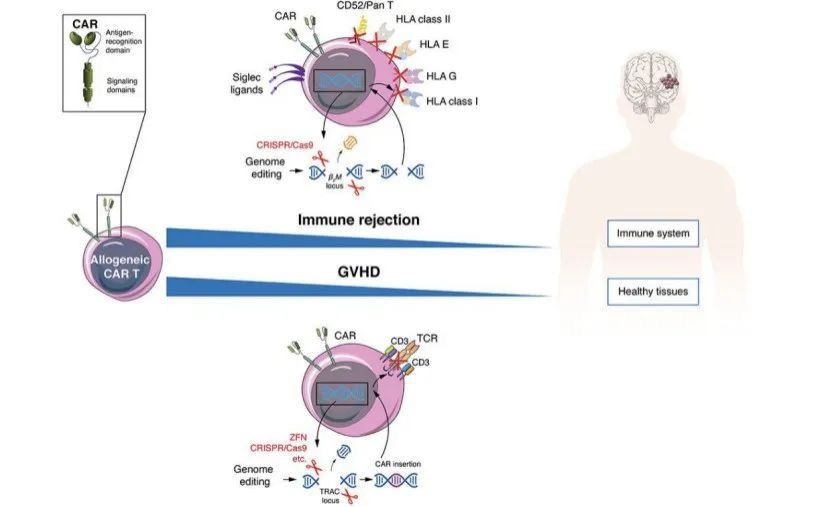
图7:“通用型”CAR-T问题及解决方案
对于一些晚期严重疾病患者而言,延迟治疗通常也会造成一定的问题。目前的阶段方案均处于临床阶段,比如诺华的 TCharge 平台和亘喜生物的 FasTCAR 平台通过简化激活和转导步骤,并把主要增殖阶段转移到人体内,实现仅需两天左右的制备期。制备时间大大缩短,也可以更及时地应用到治疗之中。
除了以上两个方面的“破局之法”,在其他方面,CAR-T细胞治疗产品也有着许多需要改进的地方,例如:副作用怎么降低、适应症的拓展等。目前也取得了部分成果。
1、降低副作用
CAR-T 细胞疗法的相关安全性问题主要是脱靶毒性和细胞因子风暴。目前遇到此问题主要解决方案为:轻度 CRS 通过退热治疗及时评估以排除其他病因,并进行抗生素治疗以避免感染;重度 CRS 采用皮质类固醇、托珠单抗及抗 IL-1 治疗(如阿那白滞素);神经系统事件用抗癫痫药物处理;感染并发症用抗菌药物治疗,防止中性粒细胞减少。
除了目前的解决方法,寻找更为严格的肿瘤特异性抗原作为靶点,显然是更好的处理方式,目前诺华申请多个和CAR-T细胞治疗的脱靶问题处理、减少细胞因子风暴等相关专利。
2、实体瘤研发进展
由于 CAR-T 在治疗血液肿瘤方面表现突出,被普遍认为是人类最有希望最终攻克癌症的创新疗法之一。尽管目前没有针对实体瘤的 CAR-T 产品上市,在临床研究阶段部分产品有了不错的进展,在攻坚实体瘤方面,各国生物技术公司都在不断努力。
①胃癌、胰腺癌等。2022年5月9日,科济药业针对 Claudin18.2的CAR-T细胞产品CT041,治疗消化系统肿瘤的研究结果发表在国际顶级期刊《Nature Medicine》杂志上,这也算是首个发表于顶级学术期刊的迄今为止最大样本量的CAR-T细胞治疗实体瘤的临床研究。在疗效方面,36例具有肿瘤靶病灶的患者中,31例患者观察到不同程度的目标病灶缩小,总客观缓解率(ORR)为48.6%,疾病控制率(DCR)为73.0%。所有胃癌患者总客观缓解率为57.1%,疾病控制率达75.0%,这个成绩可谓是相当亮眼。此外,CLDN 18.2活化还可见于食管癌、卵巢癌和肺腺癌中,因此是具有潜力治疗癌症的热门靶点。

图8:CT041研究结果在《Nature Medicine》发表
②肺癌。目前已进入肺癌治疗临床试验的CAR-T疗法的靶抗原包括CEA、DLL3、EGFR、GPC3、HER2、MSLN、MUC1、PD-L1、PSMA和ROR1等,大多尚处于临床I期研究阶段。除此之外,靶向CD47、EphA2、LunX和MAGE-A1的CAR-T也在临床前研究中展现了对肺癌细胞的强大杀伤能力。
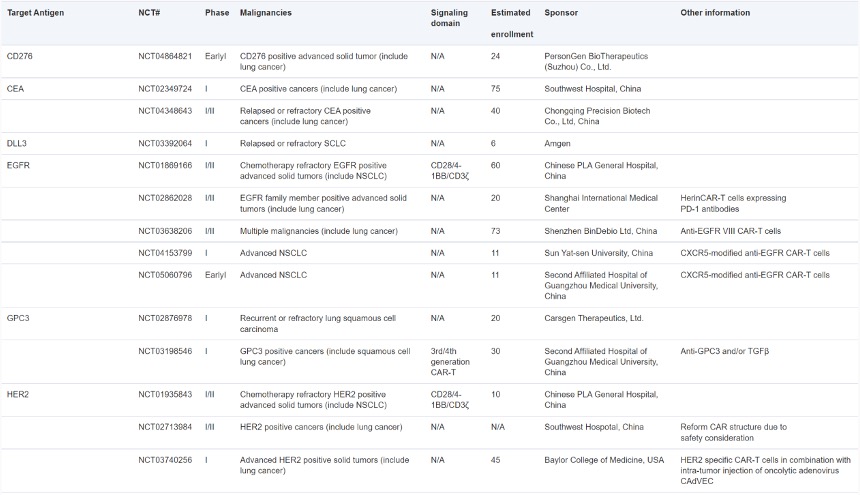
图9:CAR-T细胞治疗肺癌的临床试验
③肝癌。HCC中的CAR-T疗法靶点有GPC3、AFP、c-Met、MUC1、EpCAM、CD133、CD147、NKG2D、CEA等。
上海交通大学医学院附属仁济医院所开展的两项连续的I期研究对GPC3 CAR-T疗法在HCC中的应用进行了探索,研究共纳入13例晚期HCC患者,3年、1年和6个月总生存(OS)率分别为10.5%、42.0%和50.3%,其中1例患者在44.2个月后仍存活。9例患者发生细胞因子释放综合征(CRS),其中8例为1-2级,1例为5级,未发生3级或4级神经毒性。其他数项评估GPC3 CAR-T单独治疗或联合免疫检查点抑制剂或联合抗血管生成药物在HCC中疗效与安全性的研究正在进行中。
之前有研究团队构建了CD133特异性CAR-T细胞(CART-133),并发现CART-133细胞具有较强的细胞裂解能力,并可显著抑制体内肿瘤生长。随后,该团队进行了一项开放标签单臂I/II期临床试验,以评估CART-133细胞对晚期HCC等癌症患者的抗肿瘤作用。该研究I期纳入23例患者,包括14例HCC患者,其中9例患者病情稳定,6个月疾病控制率为43%[6]。该研究的II期阶段共纳入21例HCC患者,患者中位OS为12个月(95%CI,9.3-15.3个月),中位无进展生存期(PFS)为6.8个月(95%CI,4.3-8.4个月)。1例患者达到部分缓解(CR),14例达到疾病稳定(SD)。患者发生3级贫血2例,3级高胆红素血症4例,未见4级AE[7]。
此外,其他靶点均有相关临床研究正在进行中。
④结直肠癌。2022年4月19日,斯丹赛生物宣布,FDA已授予GCC19CART快速通道资格。斯丹赛介绍的2个剂量爬坡试验组21例患者的数据,验证了GCC19CART产品的安全性和初步疗效。其中13患者以1级剂量(1x106 cells/kg)入组,8名患者以2级剂量(2x106 cells/kg)入组。根据实体肿瘤疗效评价标准(RECIST1.1),1级剂量组客观缓解率(ORR)为15.4%(2/13),2级剂量组客观缓解率为50%(4/8)。受试患者最常见的不良反应事件是细胞因子释放综合征(CRS)和腹泻,2例患者出现神经中毒,经皮质类固醇治疗后得到缓解。总的来说,GCC19CART在复发/难治性结直肠癌患者中显示出与剂量相关的良好的临床初步疗效以及可接受的安全性。
⑤脑瘤。近期,CAR-T细胞疗法的临床试验结果再次登上国际顶级期刊《Nature》杂志。针对致命的实体脑瘤,CAR-T细胞疗法再次带来治疗曙光:接受治疗的患者,75%可以从治疗中获益,癌症症状得到缓解。研究人员表示,如果将静脉注射改为脑室内注射,有望进一步降低患者全身性的副作用发生率,比如降低CAR-T细胞治疗最常见的副作用细胞因子风暴的发生率等。

图10:《Nature》杂志刊登CAR-T细胞疗法治疗脑瘤临床试验
⑥卵巢癌。2021年,中国的创新性的CAR-T细胞疗法治疗实体瘤的治疗成果登上了国际一流学术期刊《Journal for ImmunoTherapy of Cancer》(《癌症免疫治疗杂志》)。在这项研究中,上海细胞治疗团队打造的白泽T细胞治疗技术,通过让CAR-T细胞自分泌PD-1抗体,成功帮助一名晚期卵巢浆液性腺癌女性患者延长了生存期,患者总生存时间达到17个月。在此次治疗中患者并未出现诸如发热、寒战、呕吐和肌肉酸疼等副作用,仅出现了高血压1级和乏力等轻微副作用。
除了以上几种实体瘤,黑色素瘤、胶质母细胞瘤、乳腺癌、胰腺癌等不同部位的实体瘤也有不同程度的进展。相信随着研究的不断进展,CAR-T 细胞疗法会在实体瘤治疗领域有更多新的突破。
CAR-T细胞疗法作为“后起之秀”,已经有源源不断的企业正在投身其中,随着全球CAR-T技术研发的不断深入、支付体系逐步完善、以及通用型细胞疗法的不断发展,未来CAR-T的临床适应症将不断扩充,作为未来的发展方向之一,希望CAR-T细胞疗法可以通过正在进行的研究,降低毒副作用,降低医疗成本,增加有效性和范围,提高安全性并有效生产,突破实体瘤的瓶颈,让越来越多的晚期癌症患者可以从中获益,给更多的人带来“生”的希望。

想了解更多,请关注夸克医药微信公众号